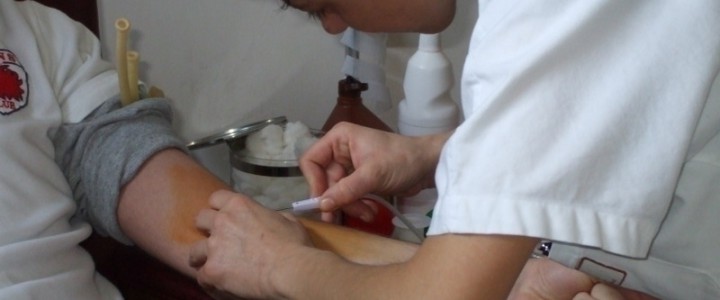
La vicenda sembra incredibile ma è vera. Ce lo hanno segnalato dei volontari impegnati nell’Avis, l’associazione che promuove la donazione volontaria del sangue con capillarità in centinaia di piccoli centri urbani del nostro paese. Grazie alla loro attività gratuita e volontaria riescono ad assicurare non solo le donazioni di sangue ma anche una sensibilizzazione al problema assai più capillare di quanto possano fare le costose campagne promozionali del ministero della salute. A tutti è capitato di incontrare nei paesi o qualche volta nelle parrocchie o nelle sale comunali dei piccoli comuni giornate della donazione di sangue. Lo si fa, gratuitamente, perché ognuno pensa in questo modo di poter comunque essere utile a qualcuno che ne ha bisogno, per un intervento chirurgico o per un incidente stradale. Non solo. E’ bene sapere che una parte del sangue donato finisce anche alle case farmaceutiche per le ricerche. La donazione di sangue in molte regioni d’Italia spesso è carente, soprattutto nella stagione estiva. Quest’anno in Lazio, Toscana, Puglia e Sardegna è mancato il sangue per le trasfusioni. A rischio ci sono la medicina d’urgenza, gli interventi chirurgici, i trapianti di organi e le trasfusioni per le terapie per le anemie croniche, per le malattie oncologiche e per le persone affette da beta-talassemia malattia che, per sopravvivere, richiede una trasfusione del sangue ogni 15 giorni.
La richiesta di donatori e di sangue è sempre elevata ma raramente è incentivata. Nelle iniziative Avis nei piccoli comuni, al massimo hai la colazione offerta dai volontari. Negli ospedali, dopo qualche settimana, ti inviano gratuitamente le analisi del sangue, non tutte ovviamente e tendenzialmente sempre meno per via dei tagli. Ma adesso a mettere i bastoni tra le ruote alle donazioni di sangue ci si è messa la burocrazia dell’Unione Europea con una direttiva che sta portando alla chiusura tutte le attività dei centri e delle associazioni Avis nei paesi e nei quartieri. I requisiti per i locali dove effettuare le donazioni volontarie di sangue sono talmente restrittivi da renderle impossibili, così come le norme più restrittive. In apparenza le intenzioni sembrano le migliori, ma le conseguenze? Se ci saranno meno donatori, da dove verrà il sangue che serve negli ospedali e per le emergenze? Semplice, verrà comprato, all’estero, a 100 euro la sacca.
La direttiva è rilevabile qui http://europa.eu/legislation_summa…/…/threats_to_health/c115 con il titolo “Norme di qualità e di sicurezza riguardanti il sangue umano e i componenti del sangue. Il testo per esteso è in fondo all’articolo.
La norma, attuata concretamente, si rivela come il frutto di una mentalità odiosamente burocratica nella quale l’Unione Europea non fa certamente rimpiangere l’Italia, anzi. Ma soprattutto non ha riscontri oggettivi. Le donazioni di sangue infatti, anche quando avvengono nelle iniziative Avis decentrate nei piccoli comuni e non negli ospedali o nei centri trasfusionali, sono controllate e certificate. Ci sono i colloqui e i controlli preventivi e sono molte le volte in cui i donatori vengono respinti perché non corrispondono ai parametri necessari alla qualità necessaria alla donazione. Soprattutto, statisticamente, né l’Unione Europea né il Ministero della Salute possono affermare che le donazioni volontarie nei piccoli centri dell’Avis abbiano prodotto episodi disdicevoli o donazioni su standard inferiori a quelli richiesti. Il risultato di tutto questo sarà la drastica riduzione dei donatori di sangue, il boom delle spese per l’acquisto di sangue all’estero e l’aumento dell’emergenza sangue nel nostro paese. Il governo e il Ministero della Salute hanno perso così una buona occasione per mandare a quel paese la burocrazia dell’Unione Europea e per risparmiare un po’ di soldi che potevano essere investiti su altri capitoli dell’emergenza sanitaria. Un volontario dell’Avis che da anni si sbatte gratuitamente per convincere la gente a donare il sangue ci ha tenuto a precisare: “Ma se la donazione che faccio invece di andare alle persone con necessità finisce gratuitamente alle case farmaceutiche, allora che se le paghino le stesse case farmaceutiche”. Insomma l’allarme è stato lanciato.
Qui di seguito il testo della nuova direttiva
Norme di qualità e di sicurezza riguardanti il sangue umano e i componenti del sangue
La presente direttiva stabilisce norme di sicurezza e qualità riguardanti il sangue * e i componenti del sangue * applicabili all’intero “percorso trasfusionale”.
In tale contesto essa si applica alla raccolta e al controllo del sangue umano e dei suoi componenti, qualunque sia la loro destinazione finale, nonché alla lavorazione, conservazione e distribuzione * degli stessi qualora siano destinati alla trasfusione.
Obblighi delle autorità degli Stati membri
In materia di licenza per i centri ematologici, gli Stati membri assicurano che le attività relative alla raccolta e al controllo del sangue umano e dei suoi componenti siano effettuate unicamente da centri ematologici * che abbiano ottenuto una designazione, un’autorizzazione, un accreditamento o una licenza a tal fine da parte delle autorità competenti.
Tutte le informazioni che devono essere fornite dai centri ematologici all’autorità competente per ottenere la designazione, il riconoscimento, l’accreditamento o la concessione di un’autorizzazione figurano nell’allegato I. Si tratta di informazioni generali (identificazione del centro ematologico, qualifiche, elenco e recapito delle persone responsabili, ecc.) e della descrizione del sistema di qualità (manuale di qualità, qualifiche delle persone impiegate, prescrizioni igieniche, dettagli relativi alle procedure di valutazione dei donatori, ecc.).
Le autorità competenti devono organizzare ispezioni e misure di controllo adeguate nei centri ematologici almeno una volta ogni due anni e devono anche prevedere misure appropriate in caso di incidenti, sospetto di incidenti o reazioni indesiderate gravi *.
Persona responsabile
Il centro ematologico designa una persona che ha le seguenti responsabilità:
assicurare che ciascuna unità di sangue o di suoi componenti sia raccolta e controllata e, se destinata alla trasfusione, sia lavorata, conservata e distribuita conformemente alle leggi vigenti nello Stato membro interessato,
fornire alle autorità competenti le informazioni necessarie ai fini della procedura di designazione, autorizzazione, accreditamento o licenza,
far sì che il centro ematologico soddisfi i requisiti riguardanti la gestione della qualità (cfr. qui di seguito).
Le suddette funzioni possono essere delegate ad altre persone aventi le qualifiche e l’esperienza necessarie.
La direttiva stabilisce le condizioni minime relative alle qualifiche della persona responsabile del centro ematologico (diploma universitario nel settore delle scienze mediche e biologiche, nonché esperienza pratica post laurea di almeno due anni).
Anche il personale del centro deve essere in possesso delle qualifiche necessarie e inoltre deve ricevere una formazione adeguata e ricorrente.
Gestione della qualità
Un sistema di qualità basato sui principi di buone prassi deve essere istituito da ogni centro ematologico e banca del sangue di un ospedale *. La Commissione è incaricata di stabilire le norme e le specifiche comunitarie relative al sistema.
Per quanto riguarda la documentazione e la tenuta di registri,
I centri ematologici devono conservare:
i documenti relativi alle procedure e agli orientamenti, i manuali di formazione e di riferimento, nonché i formulari dei resoconti,
un registro relativo alle informazioni di cui agli allegati II (Relazione sulle attività dell’anno precedente) e IV (Requisiti fondamentali relativi ai test praticati sulle donazioni di sangue intero e di plasma).
Le autorità competenti conservano i registri relativi alla domanda di accreditamento dei centri ematologici, alle disposizioni sui centri già esistenti e alle notifiche degli effetti indesiderabili e degli incidenti.
Emovigilanza *
Occorre garantire la rintracciabilità del sangue e degli emoderivati, dal donatore al ricevente. Ai fini della piena rintracciabilità, i centri ematologici e le banche del sangue degli ospedali devono istituire un sistema atto a identificare, senza possibilità di errore, ogni singola donazione di sangue e ciascuna unità di sangue e dei suoi componenti.
È opportuno garantire un livello equivalente di rintracciabilità del percorso per quanto riguarda il sangue e gli emoderivati importati da paesi terzi.
L’etichettatura dei prodotti deve essere conforme ai requisiti che figurano all’allegato III.
Qualunque incidente indesiderato grave deve essere notificato alle autorità competenti. I centri ematologici e le banche del sangue degli ospedali devono stabilire una procedura efficace intesa a ritirare dalla distribuzione il sangue e i suoi componenti associati a un incidente indesiderato grave.
Condizioni relative alle donazioni e ai donatori per garantire la qualità e la sicurezza del sangue e dei suoi componenti
In occasione della donazione di sangue, i donatori devono ricevere diverse informazioni tra cui alcuni dati sulle caratteristiche del sangue e sui prodotti derivati, nonché l’impegno del centro di raccolta del sangue di contattare il donatore qualora i risultati dei test dovessero evidenziare una qualsiasi patologia.
Si devono richiedere ai donatori alcune informazioni, quali l’identificazione, lo stato di salute, l’anamnesi medica e una firma che attesti che il donatore abbia letto e compreso le informazioni fornite.
Il donatore è oggetto di una procedura di valutazione e deve ottemperare ai criteri riguardanti l’ammissibilità fisica, come l’età, e ai criteri relativi alla donazione, come l’intervallo fra i vari prelievi. Esistono anche criteri di esclusione permanente, tanto per la protezione del donatore, quanto per la protezione del ricevente (ad esempio, in caso di malattie che mettano in pericolo il donatore o il ricevente).
L’esame del donatore comprende un colloquio che va effettuato prima di ciascuna donazione di sangue o di componente del sangue.
Occorre adottare misure per incoraggiare le donazioni volontarie e gratuite di sangue al fine di assicurare che il sangue e i suoi componenti siano forniti, per quanto possibile, mediante tali donazioni.
Ciascuna donazione di sangue e di suoi componenti deve essere oggetto di un certo numero di test elencati nell’allegato IV. Lo stesso dicasi per il sangue e i suoi componenti importati nella Comunità.
Protezione dei dati e riservatezza
Tutti i dati, comprese le informazioni di carattere genetico, devono essere resi anonimi, in modo tale che il donatore non sia più identificabile.
Codice comunitario relativo ai medicinali per il consumo da parte dell’uomo
La presente direttiva modifica il codice comunitario relativo ai medicinali per uso umano, al fine di garantire uguali norme di sicurezza e di qualità, indipendentemente dalla destinazione del sangue e dai componenti del sangue, anche in occasione della loro utilizzazione come materia prima per la fabbricazione di medicinali.
Contesto
La presente direttiva stabilisce norme di sicurezza e di qualità del sangue e dei componenti del sangue applicabili all’intero “percorso trasfusionale” nell’Unione europea (UE). Tale obiettivo risponde non soltanto all’esigenza di protezione della salute pubblica, bensì anche al buon funzionamento del mercato interno facilitando il trasferimento di questo tipo di prodotti all’interno dell’UE.
Termini chiave dell’atto
“Componente del sangue”: componenti del sangue (globuli rossi, globuli bianchi, piastrine, plasma) che possono essere preparati a fini terapeutici con vari metodi (centrifuga, filtraggio e congelamento),
Banca del sangue di un ospedale: unità ospedaliera che conserva e distribuisce sangue umano e i suoi componenti e può controllarne la compatibilità esclusivamente per l’uso all’interno dell’ospedale, comprese le attività trasfusionali all’interno dell’ospedale,
“Distribuzione”: consegna di sangue e suoi componenti ad altri centri ematologici, banche del sangue di ospedali e produttori di derivati del sangue e del plasma. È esclusa la distribuzione a scopo di trasfusione di sangue o di suoi componenti,
“Centro ematologico”: qualunque struttura o organismo che è responsabile sotto qualunque aspetto della raccolta e del controllo del sangue umano e dei suoi componenti, qualunque ne sia la destinazione, nonché della lavorazione, conservazione e distribuzione quando gli stessi siano destinati alla trasfusione,
“Emovigilanza”: insieme delle procedure di sorveglianza organizzate relative agli incidenti o alle reazioni indesiderate gravi o inaspettati dei donatori o dei riceventi, nonché al controllo epidemiologico dei donatori,
“Incidente grave”: qualunque evento negativo collegato con la raccolta, il controllo, la lavorazione, la conservazione e la distribuzione di sangue e di componenti del sangue che può provocare la morte, determinare condizioni che mettano in pericolo la vita o producano invalidità o incapacità dei pazienti, o determina o prolunga l’ospedalizzazione o la morbilità,
“Ispezione”: controllo ufficiale e obiettivo, effettuato in conformità con norme esistenti al fine di valutare il rispetto della presente direttiva e di altre normative pertinenti e di determinare i problemi,
“Prodotto del sangue”: qualunque prodotto terapeutico derivato dal sangue o dal plasma umano,
“Sangue”: il sangue intero prelevato da un donatore e trattato per la trasfusione o per l’elaborazione di prodotti derivati,
“Trasfusione autologa”: trasfusione di sangue e dei suoi componenti ottenuti attraverso predeposito in cui il donatore e il ricevente sono la stessa persona.
RIFERIMENTI
Atto Data di entrata in vigore Data limite di trasposizione negli Stati membri Gazzetta ufficiale
Direttiva 2002/98/CE
8.2.2003
8.2.2005
GU L 33 dell’8.2.2003
Atto(i) modificatore(i) Data di entrata in vigore Termine ultimo per il recepimento negli Stati membri Gazzetta ufficiale
Regolamento (CE) n. 596/2009
7.8.2009
–
GU L 188 del 18.7.2009
ATTI COLLEGATI
Misure di applicazione
Direttiva 2009/135/CE della Commissione, del 3 novembre 2009, che autorizza deroghe temporanee a determinati criteri di idoneità per i donatori di sangue intero e di emocomponenti di cui all’allegato III della direttiva 2004/33/CE alla luce del rischio di carenza dovuto alla pandemia di influenza A(H1N1) [Gazzetta ufficiale L 288 del 4.11.2009].
Questa direttiva d’applicazione, valida fino al 30 giugno 2010, offriva agli Stati membri la possibilità di derogare, in via eccezionale e a determinate condizioni, a taluni criteri di idoneità per i donatori di sangue, al fine di garantire l’approvvigionamento di sangue in caso di pandemia di influenza A(H1N1), garantendo al contempo la protezione della salute dei donatori e dei riceventi di sangue e di emocomponenti.
Direttiva 2005/62/CE della Commissione, del 30 settembre 2005, sull’applicazione della direttiva 2002/98/CE del Parlamento europeo e del Consiglio riguardante le norme e le specifiche comunitarie relative ad un sistema di qualità nei centri ematologici [Gazzetta ufficiale L 256 dell’1.10.2005].
Questa direttiva di applicazione definisce i requisiti tecnici specifici necessari al fine di garantire un sistema di qualità nei centri ematologici.
Gli Stati membri dovranno garantire che il sistema di qualità sia attuato presso tutti i centri ematologici e le banche del sangue degli ospedali in conformità delle norme e delle specifiche comunitarie di cui all’allegato della direttiva.
Direttiva 2005/61/CE della Commissione, del 30 settembre 2005, che applica la direttiva 2002/98/CE del Parlamento europeo e del Consiglio per quanto riguarda le prescrizioni in tema di rintracciabilità e la notifica di effetti indesiderati ed incidenti gravi [Gazzetta ufficiale L 256 dell’1.10.2005].
Questa direttiva d’applicazione stabilisce le prescrizioni di natura tecnica per garantire la rintracciabilità del sangue e degli emocomponenti, dal donatore al ricevente, nonché le procedure.
Gli Stati membri dovranno garantire che i sistemi e le procedure di rintracciabilità e di notifica degli effetti indesiderati e degli incidenti gravi, esistenti a livello nazionale e in tutti i centri ematologici e nelle banche del sangue degli ospedali, siano conformi alle norme e alle specifiche comunitarie definite negli allegati della direttiva.
Direttiva 2004/33/CE della Commissione, del 22 marzo 2004, che applica la direttiva 2002/98/CE del Parlamento europeo e del Consiglio relativa a taluni requisiti tecnici del sangue e degli emocomponenti [Gazzetta ufficiale L 91 del 30.3.2004].
A norma della direttiva 2002/98/CE, tale testo precisa un certo numero di informazioni, di criteri e requisiti relativi alle donazioni e ai donatori, alla conservazione, al trasporto e alla distribuzione del sangue e dei suoi componenti, nonché alla qualità e alla sicurezza del sangue e dei suoi componenti.
Relazioni di applicazione
Comunicazione della Commissione al Consiglio, al parlamento europeo, al Comitato economico e sociale europeo e al Comitato delle regioni, del 19 gennaio 2010, relativa all’applicazione della direttiva 2002/98/CE che stabilisce norme di qualità e di sicurezza per la raccolta, il controllo, la lavorazione, la conservazione e la distribuzione del sangue umano e dei suoi componenti e che modifica la direttiva 2001/83/CE [COM(2010) 3 def. – Non pubblicata nella Gazzetta ufficiale].
La presente comunicazione constata un’attuazione soddisfacente della direttiva 2002/98/CE. Gli Stati membri hanno ormai designato con successo le rispettive autorità competenti e hanno adottato un sistema d’ispezione, misure di controllo e sistemi di emovigilanza.
Gli Stati membri devono tuttavia intensificare i loro sforzi per quanto riguarda il completamento del procedimento di accreditamento, designazione, autorizzazione o licenza per ogni singolo centro ematologico.
La Commissione incoraggia la buona pratica di raccogliere le relazioni sulle attività svolte dai centri ematologici negli anni precedenti. Tali relazioni costituiscono una fonte di informazioni preziosa sia per le autorità di regolamentazione che per i cittadini.
Relazione della Commissione, del 19 giugno 2006 – Prima relazione sull’applicazione della direttiva sul sangue [COM(2006) 313 def. – Non pubblicata sulla Gazzetta ufficiale].
La relazione presenta la situazione delle misure adottate dagli Stati membri in applicazione della direttiva sul sangue. Essa riguarda i quindici Stati membri dell’UE al 31 dicembre 2003.
Nella relazione viene sottolineato che dieci Stati membri hanno adottato misure di protezione più severe rispetto a quelle previste dalla direttiva, segnatamente in materia di selezione dei donatori, di controllo biologico delle donazioni e dell’emovigilanza.
Il documento presenta la situazione a livello nazionale delle disposizioni della direttiva riguardanti:
gli obblighi a carico delle autorità nazionali competenti, segnatamente in materia di ispezioni e di controllo;
i centri ematologici e l’obbligo di designare un responsabile in possesso delle condizioni minime previste in materia di qualifiche;
la gestione della qualità a livello di ogni centro ematologico;
l’emovigilanza;
la qualità e la sicurezza del sangue e dei componenti del sangue;
la protezione dei dati.
Relazione della Commissione, del 17 maggio 2006, sulla promozione da parte degli Stati membri delle donazioni di sangue volontarie e gratuite [COM(2006) 217 def. – Non pubblicata sulla Gazzetta ufficiale].
Questa relazione presenta una panoramica delle misure adottate dagli Stati membri al fine di incoraggiare le donazioni di sangue volontarie e gratuite (indennità, possibilità di assentarsi dal lavoro, campagne d’informazione, azioni di sensibilizzazione, ecc.).
La relazione presenta parimenti le misure previste dalla Commissione per promuovere l’autosufficienza della Comunità europea per quanto riguarda il sangue e il plasma umani. Tali provvedimenti riguardano in particolare:
lo svolgimento di uno studio a livello europeo per individuare le migliori prassi seguite in materia. Tale studio mirerà a sviluppare una metodologia e regole di base da seguire per le campagne di sensibilizzazione;
la continuazione del dibattito sull’autosufficienza della Comunità, avviando una riflessione sull’ottimale utilizzazione del sangue.
Ultima modifica: 13.07.2010
- © Riproduzione possibile DIETRO ESPLICITO CONSENSO della REDAZIONE di CONTROPIANO
Ultima modifica: stampa